Home | News | Hacking | Sciences | Technology | Ti 92 | Programming | Free articles | Links | Webmaster
L'ALTERATION DES ROCHES
1. PRINCIPAUX ASPECTS DE L'EROSION CONTINENTALE
La destruction du roches constitue la source principale des
matériaux du sol. Ce phénomène intéresse
aussi bien les roches magmatiques que les roches métamorphiques
et sédimentaires.
Les actions purement mécaniques des agents d'érosion
produisent des fragments de même composition chimique que la
roche d'origine. Les phénomènes chimiques donnent des
solutions de lessivage qui sont exportées ou fournissent les
éléments pour former de nouveaux minéraux dans
le sol (néoformation). Les roches érodées
forment un manteau d'altération (éluvion). La
contribution des organismes à cette couche, sous forme
d'humus, aboutit à la formation d'un sol dont la nature et
l'épaisseur varie selon les climats.
2. LA DESAGREGATION MECANIQUE
Un certain nombre d'agents physiques produit la fragmentation des roches.
Les variations de température entraînent la dilatation ou la contraction des roches: soumise à des variations de volume incessantes, un roche se fissure puis éclate. La fissuration est importante dans les roches composées de minéraux différents n'ayant pas le même coefficient de dilatation: des microfissures apparaissent à la limite entre les minéraux. L'eau qui pénètre dans les fissures et les pores puis gèle avec augmentation de volume ajoute son effet. Les cristaux de glace s'accroissent perpendiculairement à la surface de la fente et augmentent son ouverture: la roche est gélive, elle éclate sous l'effet du gel (exemple, la craie).
La désagrégation mécanique est particulièrement importante sous les climats désertiques où les variations de température peuvent dépasser 50 °C entre le jour et la nuit. Elle est également grande sous les climats humides dont la température varie autour de 0 °C (action du gel et du dégel). Elle est responsable de l'accumulation des manteau d'éboulis caractéristiques des zones désertiques et des montagnes.
La cristallisation du sel ajoute son action le long des littoraux et dans les zones désertiques. Près des côtes, les embruns salés pénètrent dans les pores des roches. Les cristaux de sels s'y développent et produisent des craquelures. Les sulfates de Na et Mg sont les plus efficaces.
Enfin, le transport par l'eau, et accessoirement l'action du vent,
usent les matériaux et produisent des éléments
plus fins: limons, poussières...
3. ROLE DE L'EAU DANS L'ALTERATION
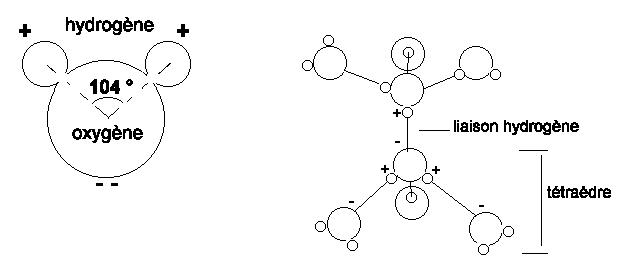
Une des caractéristique les plus importante de la surface de la Terre est l'abondance de l'eau, tant sous forme liquide que solide ou gazeuse. Les molécules d'eau sont chargées electriquement et se comportent comme des dipôles; cette propriété est dûe à la liaison covalente asymétrique qui unit les atomes d'hydrogène à l'oxygène. Les deux atomes d'hydrogène sont placés d'un seul coté et engendrent une faible charge. La nature polaire de la molécule d'eau permet l'établissement de liaisons hydrogène entre les molécules qui se disposent en groupes tétraédriques. Les propriéts de l'eau découlent de cette structure.
L'eau est un trés bon solvant car les extrémités positives ou négatives de la molécule peuvent s'attacher aux ions négatifs ou positifs.
Le groupement des molécules d'eau en tétraèdre explique la forte tension superficielle et la capillarité, et la large plage de température selon laquelle l'eau est à l'état liquide.
L'abaissement de température diminue l'agitation thermique des molécules et favorise les liaisons hydrogène: les molécules se groupent et la viscosité de l'eau augmente.
L'abaissement de température produit également l'augmentation de la densité, jusqu'à 4°C; en dessous, les molécules se réarrangent progressivement en structure hexagonale (glace) et la densité diminue jusqu'à atteindre un minimum à -22°C.
Les molécules d'eau s'ionisent en H+ et OH-..
La concentration des H+ définit le pH. A la
température ordinaire, il y a seulement 10-7 moles
par litre d'ions hydrogène (et autant de OH-) dans
l'eau pure: le pH est neutre (pH=7). L'apport d'ions hydrogène
diminue le pH; cette acidité est produite notamment par le CO2
et les acides humiques du sol.
H2 O
+ CO2 -----> H2 CO 3
------> H+ + HCO3
-
Les ions hydrogène sont responsables de la destruction des
réseaux silicatés: ils déplacent les cations
métalliques qui se recombinent avec les OH-
(hydrolyse).

Figure 1: Structure et arrangement des molécules d'eau.
4. LES REACTIONS CHIMIQUES DE L'ALTERATION
4.1 Exemple d'un profil d'altération
L'altération d'une grano-diorite à été
étudiée aux Etats Unis (Boulder, Colorado) sur une
épaisseur de 30 m. Les résultats sont portés sur
la figure. La roche est d'abord décolorée puis colorée
en rouge à la surface. Le quartz et, en une moindre mesure, le
microcline sont stables. Les plagioclases, la biotite et l'amphibole
sont détruites. De nouveaux minéraux apparaissent comme
les minéraux argileux et les oxydes de fer. L'analyse chimique
montre un enrichissement en Al2 O 3,
Fe 2 O 3 et K2
O, un appauvrissement en Si O 2, Fe O, Ca
O et Na 2 O.

Figure 2: profil d'altération sur une roche silicatée.
4.2 Principales réactions d'altération
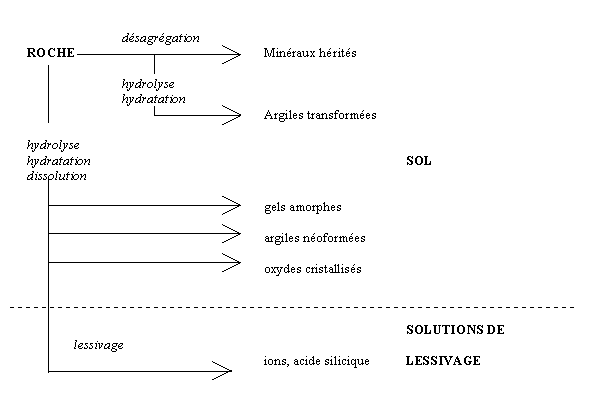
L'altération chimique des roches se fait en présence d'eau; elle a lieu essentiellement en climat humide. Les réactions sont des hydrolyses, accessoirement des oxydations, des hydratations, des décarbonatations pour les roches calcaires. Les éléments solubles sont lessivés en partie, parfois en totalité sous les climats trés agressifs. Les parties insolubles restent sur place telles quelles ou se recombinent avec les ions disponibles (phénomène d'héritage). Des composés intermédiaires mal cristallisés (gels), des tronçons de chaînes silicatées et des ions en solution se recombinent en minéraux de néoformation, principalement des argiles. Les organismes peuvent intervenir à tous les stades de ce processus. Ils fournissent en particulier des matériaux minéraux ou organiques.
a) Dissolution
Ce processus physique simple implique les roches salines: sel
gemme, potasse et gypse.
b) Oxydation et réduction
Les oxydations intéressent surtout le fer qui passe de
l'état fereux à l'état ferrique.
olivine + oxygène ---------> oxyde ferrique + silice
Fe2 Si O 4
+ 1/2 O 2 --------> Fe2 O
3 + Si O 2
Les réductions sont plus rares; elles interviennent dans
les milieux hydromorphes et produisent en particulier le passage du
fer ferrique au fer ferreux soluble (cas des sols de type gley)
c) Hydratation
C'est une incorporation de molécules d'eau à certains minéraux peu hydratés contenus dans la roche comme les oxydes de fer; elle produit un gonflement du minéral et donc favorise la destruction de la roche.
d) Décarbonatation
Elle produit la solubilisation des calcaires et des dolomies généralement sous l'action du CO2 dissous dans l'eau:
Ca CO 3 + CO 2
+ H 2 O -------> Ca (CO 3
H) 2 soluble
e) Hydrolyse
Les hydrolyses, c'est à dire la destruction des minéraux par l'eau, sont les principales réactions d'altération.
L'hydrolyse est totale lorsque le minéral est détruit en plus petits composés possibles ( hydroxydes, ions).
Cas d'un feldspath sodique, l'albite:
Na Al Si 3 O 8 + 8 H 2 O -------> Al (OH) 3 + 3 H 4 SiO 4 + Na+ OH -
albite + eau ------------------------> gibbsite + acide silicique + ions
précipité +solution de lessivage
(*) Al (OH) 3 ou Al2 O3, 3 H2 O
Les corps résultants peuvent ensuite réagir entre eux et donner des minéraux argileux (néoformation).
L'hydrolyse est partielle lorsque la dégradation est incomplète et donne directement des composés silicatés (argiles). Ces composés diffèrent selon les conditions de milieu. L'hydrolyse partielle de l'albite donne soit de la kaolinite, soit des smectites.
(1) Formation de kaolinite:
Na Al Si 3 O 8
+ 11 H 2 O ------> Si 2 O
5 Al 2 (OH) 4
+ 4 H 4SiO 4 + 2 ( Na+,
OH -)
albite + eau ----------------------> kaolinite + ac.silicique +
ions
(2) Formation de smectite
2,3 Na Al Si 3 O 8 + H 2 O ------> Si 3,7 Al 0,3 O 10 Al 2 (OH) 2 Na 0,3 +3,2 H 4 SiO 4 + 2 ( Na+, OH- )
smectite
Cette 2ème réaction reste assez théorique car
d'autres ions y participent, en particulier le Fer (Fe 3+).
4.3 Minéraux formés
Les nouveaux minéraux formés sont en général
des phyllosilicates. Ces minéraux proviennent soit de la
transformation d'un phyllosilicate pré-existant, soit d'une
néoformation à partir d'un silicate non en feuillet
dont la structure est complètement détruite. Les
réactions ont lieu surtout dans le sol.
Les phyllosilicates formés sont des minéraux argileux de deux types:
* type 1/1: le feuillet comporte 1 couche à tétraèdres SiO 4 et 1 couche à octaèdres AlO6
*type 2/1: le feuillet comporte 3 couches, à savoir 1 couche octaèdrique comprise entre 2 couches tétraèdriques.
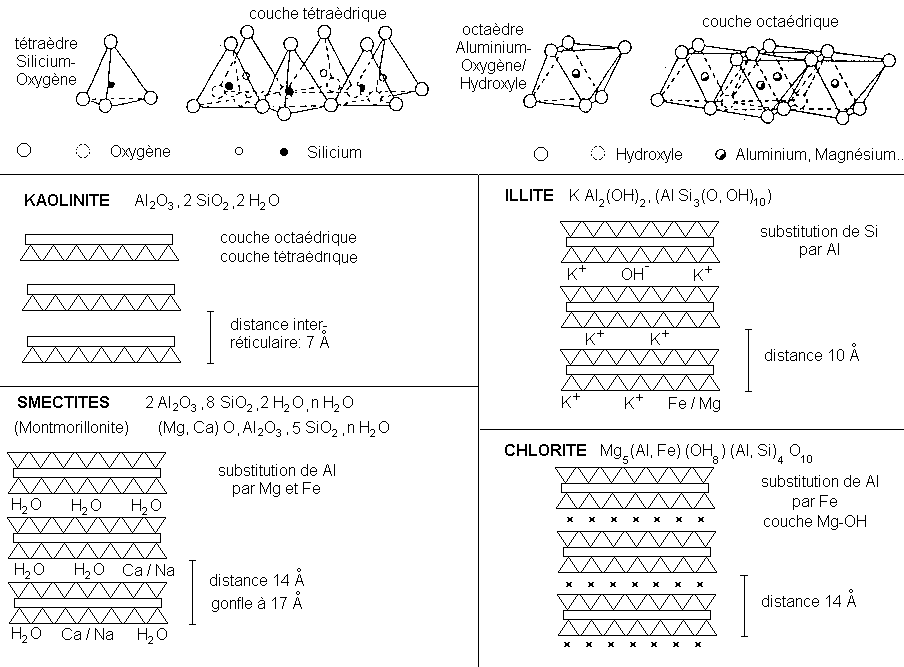
Figure 3: Structure des phyllosilicates argileux.
Lorsque les nouveaux minéraux argileux sont formés à partir des micas (muscovites, biotites et chlorites), le réseau cristallin est plus ou moins conservé, on parle de transformation. Lorsqu'ils sont formés à partir de silicates qui ne sont pas en feuillets (feldspaths, amphiboles, olivine...), le réseau cristallin du minéral d'origine est complètement détruit, on parle de néoformation.
* Muscovite
Elle est assez stable. Sa fragmentation donne des petites
paillettes de même composition chimique appelées
séricite. Son altération chimique se fait par perte
progressive d'ion K+; elle donne de l'illite, puis des argiles de 2
types selon les conditions de drainage du milieu: la kaolinite en
milieu lessivé, les smectites en milieu confiné. Trés
schématiquement:
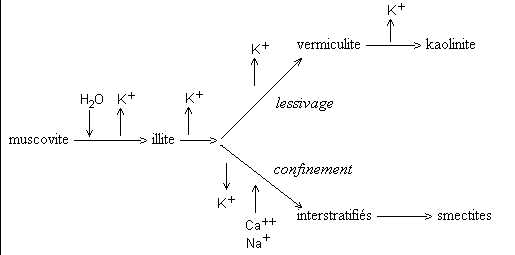
Corrélativement, la distance inter-réticulaire, qui
sépare les feuillets d'argiles, change et passe de 10 A°
(muscovite, illite) à 14 A° (smectite) ou à 7 A°
(kaolinite). Les ions K+ assurent la cohésion des feuillets
argileux. L'altération se manifeste par l'exfoliation des
feuillets, bien visibles au microscope électronique, qui
produit des particules de plus petites taille, qelques 0,1 microns,
et augmente la surface de contact du minéral et la capacité
d'échange des cations avec les solutions du milieu.
* Feldspaths
Bien qu'il s'agissent de tectosilicates, leur altération
est comparable à celle de la muscovite (voir également
paragraphe 4.2).
* Biotite
Sa résistance à l'altération dépend de la teneur de Fe++ dans le cristal; son état d'altération est exprimée par la quantité de K+ extraite du réseau. La biotite peu oxydée (surtout à Fe++) est trés altérable et se comportent comme les autres minéraux ferro-magnésiens (pyroxènes...); elle donne en particulier des vermiculites et smectites et de l'oxyde ferrique qui précipite. La biotite plus oxydée (Fe+++ surtout) est plus stable.
* Autres ferromagnésiens
Leur altération est semblable à celle de la biotite
peu oxydée; ils donnent des vermiculites, des smectites, des
chlorites ou des argiles magnésiennes si le milieu est trés
confiné.
4.4. La complexolyse
C'est une variante de l'hydrolyse en présence de matière
organique. Elle se produit sous climat froid (boréal) et
tempéré. Les composés organiques de l'humus
extraient les cations métalliques des réseaux
cristallins. Les minéraux sont détruits; les cations
sont fixés sur les composés organiques en donnant des
complexes organo-métalliques. Les cations se liant aux grosses
molécules organiques de l'humus sont surtout les ions Al 3+,
Fe 2+ et Fe 3+.
5. FACTEURS CONTROLANT L'ALTERATION
5.1 Facteurs propres au minéral
Résistance d'un minéral à l'altération
L'énergie de liaison varie selon le type d'ions concernés. Le K+ est faiblement lié à l'oxygène, le Fe++ et le Mg++ le sont moyennement; le Si 4+ établit au contraire des liaisons trés fortes. On comprend ainsi que le quartz, tectosilicate ne comportant que des liaisons fortes entre le silicium et l'oxygène, résiste mieux à l'altération; l'olivine en revanche, contenant des cations moins liés (Fe++ et Mg++) a un réseau cristallin plus fragile.
GOLDICH (1938) a établi l'ordre de résistance des
minéraux à l'altération:
Labile olivine ...................................................................plagioclases Ca
augite
.............................................plagioclases Ca-Na
hornblende ................plagioclases
Na-Ca
biotite .........plagioclases Na
feldspaths K
muscovite
Résistant
............................................quartz
On remarque que cet ordre évoque les suites de BOWEN: ce n'est pas un hasard. Dans un magma, l'olivine cristallise à haute température, elle est donc particulièrement instable dans les conditions de surface; elle est la plus labile. Le quartz, en revanche est formé à une température moins élevée, il est plus stable.
Le type de réseau cristallin intervient dans la stabilité du minéral en surface. Les phyllosilicates, comme la muscovite, résistent mieux à l'altération.
Des travaux ont permis d'évaluer la vitesse d'hydrolyse
d'un minéral silicaté en mesurant la vitesse de
libération de la silice issue du minéral dans le milieu
. Cette vitesse est fonction de la surface de contact du minéral,
du pH et d'une constante de vitesse de libération "k"
propre au minéral qui est mesurée en mole/m2/an;
voici quelques valeurs de k:
anorthite : 1,76 10-1 Feldspath K : 5,26 10-5néphéline : 8,83 10-2 olivine : 3,78 10-5
Enstatite : 3,15 10-3 muscovite : 8,09 10-6
albite : 3,75 10-4 quartz : 1,29 10-7
On voit qu'on passe d'un facteur 10-1
(anorthite) à un facteur 10-7
(quartz). On retrouve plus ou moins l'ordre établi par
GOLDICH.
Solubilité des ions
Le lessivage des ions dans le sol dépend de leur solubilité.
a) Mobilité des ions
La mobilité d'un ion dépend de son rayon et de sa charge ionique.
* Rayon ionique
Si++++ :r = 0,42 A°
Al +++ : r = 0,51 A°
O-- : r = 1,4 A°
La taille des ions détermine leur arrangement cristallin;
le nombre de coordination d'un ion par rapport à l'oxygène
est le nombre d'ions oxygène qui peuvent se disposer autour de
l'ion considéré:
- Silicium : nombre de coordination 4, l'arrangement est un tétraèdre;
- Aluminium: nombre de coordination 6, l'arrangement est un octaèdre.
*Charge ionique :
la charge Z d'un ion est égale à 1+, 2+, 3+...
* Potentiel ionique:
c'est le rapport Z/r; il détermine le comportement des ions. La classification établie par GOLDSCHMIDT distingue 3 groupes d'ions d'après la valeur du potentiel ionique:
* Z/r < ou = 3 : les cations solubles, gros ions faiblement chargés;
* 3 < Z/r < 10 : les hydrolysats, hydroxydes insolubles;
* Z/r > 10 : les oxyanions solubles, anions complexes avec oxygène.
La répartition des charges électriques à la
surface de l'ion explique son comportement vis-à-vis de l'eau.
* oxyanions solubles: leur potentiel ionique est grand, leur surface est fortement chargée. Ces ions dissocient les H+ des molécules d'eau et s'associent avec les O--: les ions soufre donnent des ions sulfates (SO4)2-, les ions carbone des carbonates (CO 3)2-, les ions phosphore des phosphates (PO4)3-...
* hydrolysats: la dissociation de l'eau est partielle en H+ et OH-. Les cations s'unissent aux OH- et forment des hydroxydes insolubles (Fe2 O3, Al2 O 3...)* cations solubles: leur potentiel ionique et leur densité de charge de surface sont faibles. Ils n'ont pas d'action sur la molécule d'eau et restent dispersés.
La valeur du potentiel ionique permet donc d'expliquer le lessivage des cations solubles et des oxyanions comme le potassium, les sulfates, l'immobilité relative des hydrolysats comme l'Al (OH)3 (gibbsite).
En résumé, on peut dire:
les gros ions peu chargés sont mobiles (K+, Ca++, Fe+ ...)
les petits ions trés chargés se combinent avec O et sont mobiles (Si, S, P...)
les ions de taille et charge moyenne se combinent avec OH et sont
immobiles (Fe+++, Al+++...)
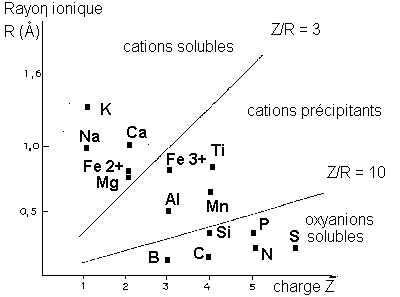
Figure 4: classification de Goldschmidt.
5.2 Facteurs externes contrôlant l'hydrolyse
Ce sont les facteurs physico-chimiques qui participent notamment à
la définition du climat:
* la concentration en SiO2 exprimée en concentration d'acide silicique H 4 SiO 4,
* la concentration en cations basiques (Na+, Ca++, K+),
* le pH déterminé en particulier par les acides organiques,
* la température dont l'augmentation régit la vitesse des réactions et la possibilité de dissolution des ions dans l'eau,
* la vitesse de circulation de l'eau dans le milieu
(drainage) exprimant les conditions de confinement ou de lessivage.
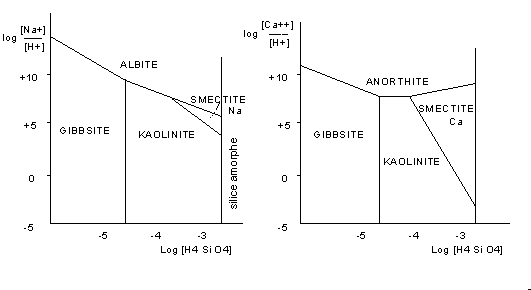
Figure 5: champ de stabilité de deux minéraux en fonction de la concentration de la solution en ions et en acide silicique.
On peut étudier expérimentalement les champs de
stabilité de quelques minéraux , dans les conditions de
surface (t = 25°C, pression atmosphérique), en fonction de
la concentration en silice et en cations. On voit que l'albite est
stable pour des concentrations en Na+ et silice élevée;
quand ces concentrations deviennent faibles, l'albite est totalement
hydrolysée en gibbsite, hydroxyde d'aluminium de formule
Al(OH)3 (ou Al2 O3,
3 H 2 0) ; pour des teneurs moyennes,
elle est hydrolysée partiellement et se transforme en
kaolinite ou en smectite sodique selon la teneur en ion Na+. Le même
schéma est observé pour l'anorthite (plagioclase
calcique); le champ de stabilité de la smectite calcique est
plus vaste; ce minéral sera plus commun dans les produits
d'altération.
5.3 Solubilité du Fer
La solubilité du Fe dépend de la stabilité du système Fe2+ / Fe3+. De plus, l'hydroxyde ferrique, hydrolysat insoluble, peut être solubilisé par ionisation en pH acide.
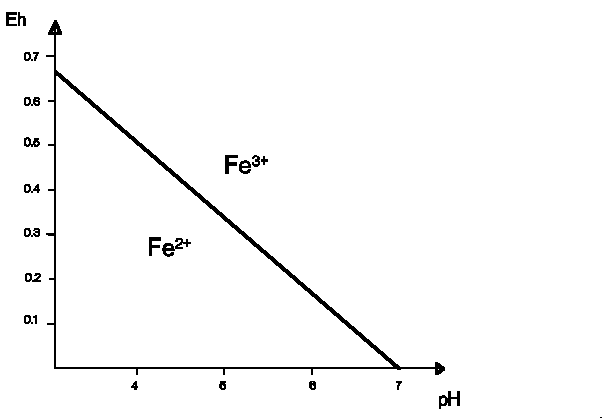
Figure 6 : stabilité du système Fe2+
/ Fe3+ en fonction de l'Eh et du pH
pour une solution diluée à température de 25°C
et pression atmosphérique.
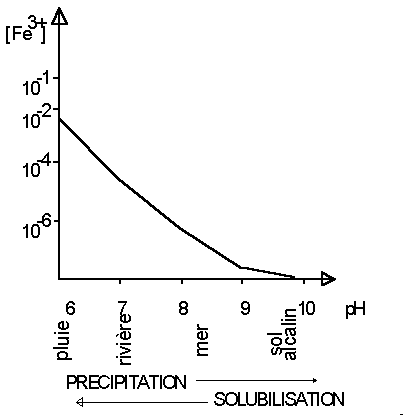
Figure 7 : solubilité du Fe3+ en fonction du pH de la solution.
On voit que dans les conditions naturelles, l'état
d'oxydation du fer dépend du pH: le fer ferreux est stable à
pH acide, le fer ferrique à pH basique. Dans les milieux à
l'abris de l'air (sol hydromorphe, fond de marécage...) le fer
est à l'état ferreux ; il passe à l'état
ferrique au cours de l'altération à l'air (sols
latéritiques). Il est lessivé en partie par l'eau de
pluie légèrement acide et transporté par les
rivières. Arrivé dans l'eau de mer à pH basique,
sa solubilité diminue fortement (voir Figure 1-6) et il
précipite.
5.4 Solubilité de la silice
Elle est principalement sous forme d'acide silicique H 4 SiO 4; l'eau de rivière en contient environ 13 mg/l. Le pH a peu d'action sur sa solubilité dans les conditions normales (la solubilité de la silice augmente au delà de pH = 9 ). Il y a en fait relativement peu de silice transportée car les ions Al 3+ réagissent sur elle pour donner des amas colloïdaux silico-alumineux peu mobiles. La figure 7 montre la solubilité du quartz en fonction du pH et de la température. L'axe des ordonnées indique la quantité de silice perdue par le cristal et passant en solution. Cette quantité est grossièrement multipliée par 10 entre 0 et 60°C; l'action du pH ne se fait sentir qu'au delà de pH = 9.
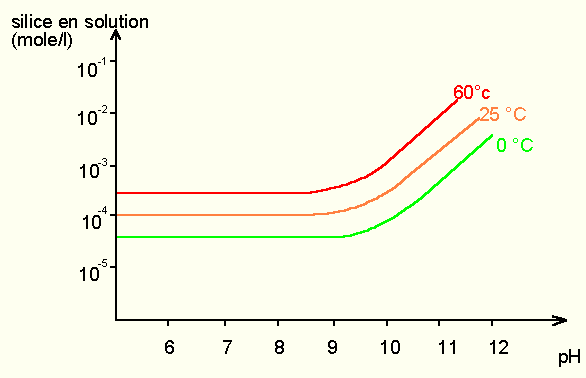
Figure 8: solubilité de la silice en fonction du pH et de la température.
6. ROLE DES ORGANISMES DANS L'ALTERATION
6.1 Principaux effets des êtres vivants sur les roches
Les études ont porté notamment sur l'effet des organismes adhérant à une roche: algues vertes, diatomées,Les études ont porté notamment sur l'effet des organismes adhérant à une roche: algues vertes, diatomées, lichens, champignons, bactéries. Ceux-ci adhèrent à la surface grâce en particulier à des organes appropriés qui pénètrent dans les fissures et exfolient les minéraux lamellaires (hyphes de lichen exfoliant la biotite). Ils produisent une désagrégation et une microdivision de la surface de la roche ainsi qu'une attaque chimique par sécrétion d'acide oxalique produit par les lichens comme par les racines des végétaux supérieurs. Les cations des minéraux sont extraits par complexolyse. Sous les lichens adhérant à la roche est mise en évidence la formation de composés mal cristallisés à base de Si, Al et Fe, de nombreux composés à base de Ca et des gels organo-minéraux , résultats de la complexolyse et précurseurs du sol.
6.2 Rôle de la matière organique
Elle intervient dans la complexolyse (voir paragraphe 4.4. et le
chapitre "Les sols").
7 BILAN DE L'ALTERATION
La destruction des édifices cristallins silicatés produit des fragments de chaine silicatées qui, au moins dans un premier temps, restent sur place, et des ions solubles qui sont emportés par l'eau ou lessivés. L'importance respective de l'héritage, les transformations et les néo-formations est étroitement liée à l'intensité de l'altération et au lessivage. Pour une altération et un lessivage faible , les argiles 2/1 de type illite sont en majeure partie héritées. Avec l'augmentation de l'intensité de l'altération, ce sont des smectites ou de la kaolinite, plus pauvres en silice, qui sont synthétisées en fonction de l'importance du lessivage et des ions disponibles (sols méditerranéens, podzols). Pour un fort lessivage, les cations solubles sont entraînés et les phyllosilicates ne peuvent plus se former: il reste sur place le quartz et les oxydes de fer et d'aluminium (sols latéritiques).
REFERENCES
CAMPY M. et MACAIRE J.J. (1989) - Géologie des formations superficielles. Masson.
CHAMLEY H. (1987) - Sédimentologie. Dunod.
COJEAN I. et RENARD M. (1997) - Sédimentologie. Dunod.
POMEROL C., RENARD M. et LAGABRIELLE Y. (2000) - Eléments de géologie. Dunod.
TUCKER M.E. (1981) - Sedimentary petrology. An introduction. Blackwell.
jacques.beauchamp@sc.u-picardie.fr
depuis le 30/09/2003